Gustavo Bonfadini1, Filipe Armond2
1. Responsável Técnico do Banco de Olhos do Rio de Janeiro –INTO;
1. Responsável Técnico Transplante de Córnea – Hospital Copa Star, Rede D’or São Luiz
1. Doutor em Oftalmologia e Ciências Visuais – Universidade Federal de São Paulo – UNIFESP;
1. Chefe setor de córnea e doenças externas – Instituto de Oftalmologia do Rio de Janeiro/Santa Casa Gamboa – RJ.
2. Residente de oftalmologia – Instituto de Oftalmologia do Rio de Janeiro/Santa Casa Gamboa – RJ.
INTRODUÇÃO
A alergia ocular, clinicamente referida como conjuntivite alérgica, caracteriza-se como uma resposta de hipersensibilidade mediada por imunoglobulina E (IgE) no olho, desencadeada predominantemente por aero alérgenos, notadamente ácaros da poeira doméstica e pólen de gramíneas e substâncias químicas. Os sintomas apresentam-se comumente como prurido ocular ou periocular, lacrimejamento e hiperemia conjuntival, manifestando-se de forma persistente ao longo do ano ou de maneira sazonal1.
Como a conjuntiva é um tecido ricamente vascularizado, com abundantes mediadores imunes e exposta diretamente ao ambiente, é frequentemente envolvida em reações imunes e alérgicas. As cascatas de eventos relacionadas com estas reações são responsáveis pelos sinais e sintomas tipicamente associados e estas conjuntivites.
A alergia ocular, é de elevada prevalência, frequentemente permanece subdiagnosticada, representando um desafio clínico significativo. Além de debilitar a qualidade de vida do paciente, a condição apresenta potencial danoso à saúde ocular, especialmente nos casos em que resulta em cicatrização corneana severa e prejudica a uma adequada programação cirúrgica ocular. Em muitos pacientes, a conjuntivite está associada a outras manifestações alérgicas, notadamente rinite, asma e dermatite atópica que devem ser controladas em conjunto1.
ANATOMIA DO OLHO
O olho é subdividido em três principais componentes: a camada externa, compreendendo córnea e esclera; a camada média, que inclui trato uveal (íris, corpo ciliar e coroide); e a camada interna, representada pela retina.
CONJUNTIVA
A conjuntiva, uma membrana mucosa fina e transparente, reveste a esclera e as pálpebras, internamente denominado fundo de saco. Possui rica vascularização, constituída por tecido conjuntivo e linfóide. Entre a episclera e a conjuntiva, encontra-se a cápsula de Tenon, uma membrana colagenosa espessa que envolve o olho do nervo óptico ao limbo2. (Figura 1).
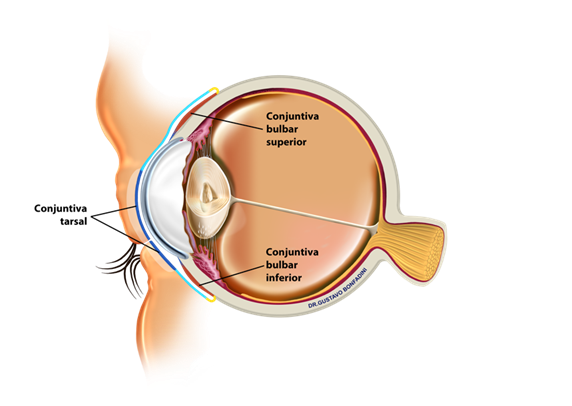
Fonte: Adaptado com autorização Dr.Gustavo Bonfadini do website: www.gustavobonfadini.com.br
A camada epitelial é a primeira, composta por células caliciformes, glândulas unicelulares que secretam mucina, essencial para a integridade da superfície ocular. Melanócitos e células de Langerhans também estão presentes, sendo os primeiros mais comuns no limbo, fórnice, prega semilunar, carúncula e nas perfurações dos vasos ciliares anteriores2.
A camada subsequente é a substância própria, composta por uma camada linfóide superficial e uma camada fibrosa mais profunda, rica em mastócitos, linfócitos, células plasmáticas e neutrófilos. Destacam-se os linfócitos T, abundantes na conjuntiva, e as agregações linfóides conhecidas como tecido linfóides associado à conjuntiva (CALT)3.
A terceira camada é a fibrosa, que contém vasos, nervos e as glândulas de Krause. A conjuntiva, dividida em conjuntiva palpebral, bulbar e fórnice, tem a função de proteger a superfície ocular e manter a lubrificação.
A conjuntiva palpebral abrange a conjuntiva marginal, tarsal e orbital, sendo a marginal uma transição entre a pele da pálpebra e a conjuntiva propriamente dita. O fórnice é uma dobra que reveste o fundo de saco e possui quatro regiões: superior, inferior, lateral e medial. A conjuntiva bulbar, a mais fina, é transparente, permitindo a visualização clara da esclera e dos vasos subjacentes. A conjuntiva límbica, parte da conjuntiva bulbar, cobre a região límbica e se funde com o epitélio corneano2.
CÓRNEA
A córnea é um tecido transparente, avascular, aproximadamente 70% do poder dióptrico da refração total do olho e, portanto, com grande importância para a qualidade da visão. É dividida em seis camadas: Epitélio, Membrana de Bowman, Estroma, Membrana de Pré-Descemet (Dua), Membrana de Descemet e Endotélio4.
As funções principais da córnea são: transmissão e refração da luz, e proteção contra a invasão de micro-organismos, atuando de forma mecânica e bioquímica como uma barreira entre o interior do olho e o meio ambiente.
Diversas doenças de origem degenerativa, infecciosa ou traumática podem levar a alterações da função óptica ou transparência da córnea, levando à diminuição da acuidade visual e resultar na necessidade de transplante. Os resultados bem sucedidos nos pacientes submetidos ao transplante penetrante e ao transplante lamelar anterior e posterior de córnea são consequências de uma indicação adequada do transplante e de uma superfície ocular em condições adequadas para um bom resultado cirúrgico.
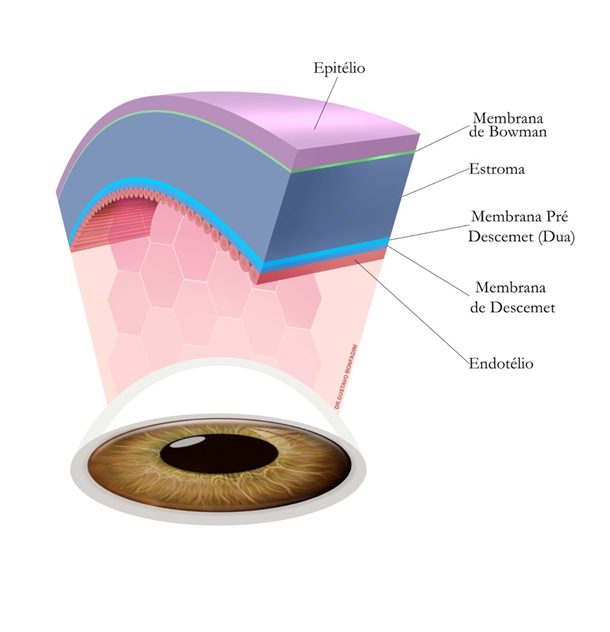
Fonte: Contribuições ao diagnóstico e tratamento cirúrgico de ceratopatias / Carlos Gustavo Bonfadini Rocha. – São Paulo, 2017. Tese (Doutorado) – Universidade Federal de São Paulo. Escola Paulista de Medicina. Programa de Pós-Graduação em Oftalmologia e Ciências Visuais
SEMIOLOGIA DA ALERGIA OCULAR
O diagnóstico de alergia ocular é baseado na história familiar e pessoal de atopia, sintomas, sinais clínicos e, eventualmente, testes adicionais5. A alergia ocular pode estar associada à rinite alérgica em 97% das crianças, asma em 56% e dermatite atópica em 33%6.
Geralmente é bilateral, com prurido, acompanhado por lacrimejamento e sensação de queimação, sendo o prurido o sintoma mais comum e distúrbios visuais e fotofobia podem ocorrer em casos graves.
Diante de uma suspeita de alergia ocular, é importante estabelecer a origem etiológica de sua condição e estabelecer se seus sintomas são devidos a uma condição primária ou são secundários a uso de medicações, outras doenças, como olho seco ou blefarite, que são causas frequentes de inflamação conjuntival e cujo tratamento deve se concentrar no tratamento das causas subjacentes7.
Uma avaliação minuciosa com uma boa anamnese, investigação clínica e a realização de exames complementares permite otimizar as chances de estabelecer um diagnóstico etiológico preciso, e assim tratar o paciente corretamente. A avaliação inicial deve incluir aspectos relevantes do exame oftalmológico geral e, em seguida, concentrar-se no exame específico da condição alérgica previamente a cirurgia proposta.
ANAMNESE
Alguns questionamentos na investigação de alergia ocular:
– Inicio e duração dos sintomas alérgicos, caracterizando a evolução e recorrência.
– História de alergias, asma, eczema, atopia, etc.
– Exposição a diferentes tipos de animais, ambientes e ou substâncias.
– Identificar uso de medicações e colírios.
– Fatores que exacerbam os sintomas alérgicos.
– Apresentação uni ou bilateral.
– Presença de secreção e caraterísticas: mucosa, serosa, purulenta ou filamentosa.
– Hábito de coçar os olhos (pesquisar a presença de astigmatismo irregular e ceratocone) na córnea.
– Uso de lentes de contato: uso do regime, tipo de lentes, tempo do descarte, higiene, líquidos de limpeza, etc.
– Comprometimento imunológico: imunossupressão, quimioterapia, transplantes prévios, etc.
– Doenças sistêmicas: atopia, síndrome de Stevens Johnson, câncer, etc.
– Exposição à fumaça do tabaco: fumante ativo ou passivo, uso de drogas ilegais.
– Ocupações de trabalho e hobbies, exposição a poluentes do ar, viagens, hábitos de exercício, dieta, etc.
AVALIAÇÃO DO CONTROLE DA ALERGIA
Um exame oftalmológico com lâmpada de fenda pode revelar presença de secreção aquosa ou mucoide, edema das pálpebras, quemose, hipertrofia papilar na conjuntiva palpebral, hiperemia conjuntival, nódulos de Horner-Trantas, ceratite e eventual envolvimento da córnea8.
O tratamento dos diferentes tipos de alergia ocular visa a eliminação dos alérgenos, a modulação do sistema imune e a inibição farmacológica dos mediadores químicos envolvidos na resposta imunoalérgica9.
Na maioria dos casos de alergia ocular, observa-se uma resposta satisfatória ao tratamento antialérgico tópico convencional, proporcionando um prognóstico visual positivo. No entanto, uma parcela das ceratoconjuntivites crônicas apresenta resposta inadequada ao tratamento convencional, resultando em desafios no controle da inflamação alérgica.
Isso não apenas aumenta o risco de comprometimento visual, mas também pode dificultar a obtenção de resultados cirúrgicos ideais, especialmente quando a alergia ocular está associada a intervenções oftalmológicas.
São considerados fatores de mau prognóstico no tratamento alergia ocular: história familiar importante de alergias, ambos os genitores alérgicos, início precoce do quadro alérgico (< 4 anos), múltiplas alergias (dermatite) e úlceras em escudo de repetição9.
O objetivo do tratamento da alergia ocular é minimizar os efeitos inflamatórios associados à resposta alérgica, promovendo alívio nos sintomas e prevenindo as complicações associadas com o prolongamento dessa inflamação ocular no período de pós operatório do transplante de córnea e conjuntiva e também reduzir o risco de neovascularização da córnea e uma possível rejeição do transplante.
Recentemente, Sánchez-Hernandez e cols10 validaram um questionário (Tabela 1) para avaliação de gravidade e controle clínico da conjuntivite alérgica que pode ser útil na avaliação pré operatória dos candidatos a transplante de córnea e conjuntiva.
| Sintomas | Controlado (todos os critérios abaixo) | Não controlado (pelo menos 1 dos seguintes) |
| Prurido | Sem sintomas ou poucos sintomas < 2 dias/semana | Qualquer intensidade se presente > 2 dias/semana |
| Lacrimejamento | ||
| Desconforto visual | ||
| Escala visual analógica | < 5 cm | ≥ 5 cm |
| Hiperemia (escala de Efron) | 0-1 | 2 a 4 |
Nesse questionário são avaliados: escala visual analógica associados a sintomas e hiperemia ocular. A avaliação deste último item é realizada através da hiperemia conjuntival e limbar separadamente, utilizando a escala de Efron11. (Figura 3)
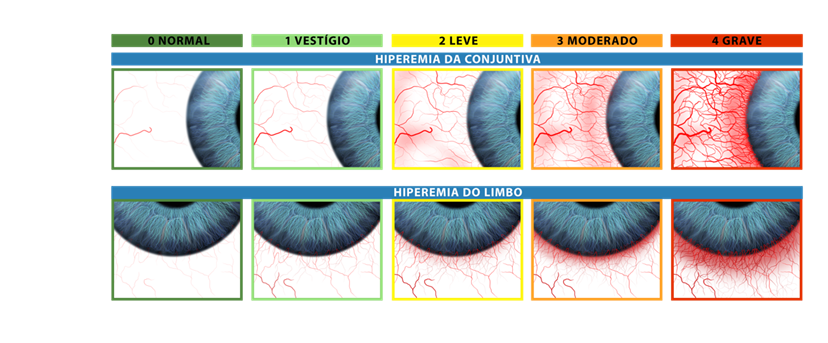
Fonte: Dr.Gustavo Bonfadini, 2023. Ilustrador Vagner Coelho, Adaptado de Efron et al11.
De maneira didática alguns sintomas da conjuntivite alérgica que podem ser avaliados e mensurados10 são: prurido, lacrimejamento e vermelhidão. Cada um dos sintomas é avaliado em uma escala de 0 (sem sintoma) a 3 (sintoma grave) e em uma escala visual analógica (0–10; 0 = sem sintomas, 10 = gravidade máxima). A hiperemia ocular pode ser medida com a escala de graduação de Efron adaptada (0–4; 0= normal, 4 = grave).
Além da carência de questionários clínicos, a dificuldade na graduação dos sintomas oculares também surge por ser uma avaliação observador-dependente. Portanto, é recomendável que, independentemente dos critérios escolhidos e o equipamento de documentação, o médico esteja familiarizado com o uso consistente da mesma, compreendendo suas vantagens e desvantagens. A documentação com uso de imagens em alta resolução da superficie ocular aprimora a troca de informações dentro da equipe multidisciplinar, resultando em um melhor acompanhamento do paciente com alergia.
Há uma necessidade de avançar no desenvolvimento de questionários mais abrangentes capazes de mensurar a gravidade e controle dos diversos tipos de conjuntivite alérgica em diferentes faixas etárias. Isso contribuirá para um acompanhamento e controle mais eficazes dos pacientes com alergia ocular e na avaliação pré cirúrgica.
TRATAMENTO OCULAR EM CASOS DE ALERGIA
Os principais objetivos do tratamento são diminuir os sintomas e minimizar as complicações através do controle do processo inflamatório por meio de medidas ambientais, profiláticas, e se as medidas não farmacológicas forem insuficientes, inicia-se o tratamento farmacológico tópico com antihistamínicos, agentes estabilizadores de membrana de mastócitos, drogas de múltipla ação, anti-inflamatórios não esteroides (AINEs) e corticosteroides(Tabela 2 e 3)8,12-17.
Tabela 2. Classe medicamentosa, mecanismo de ação, efeitos adversos e dosagem do tratamento tópico na conjuntivite alérgica.
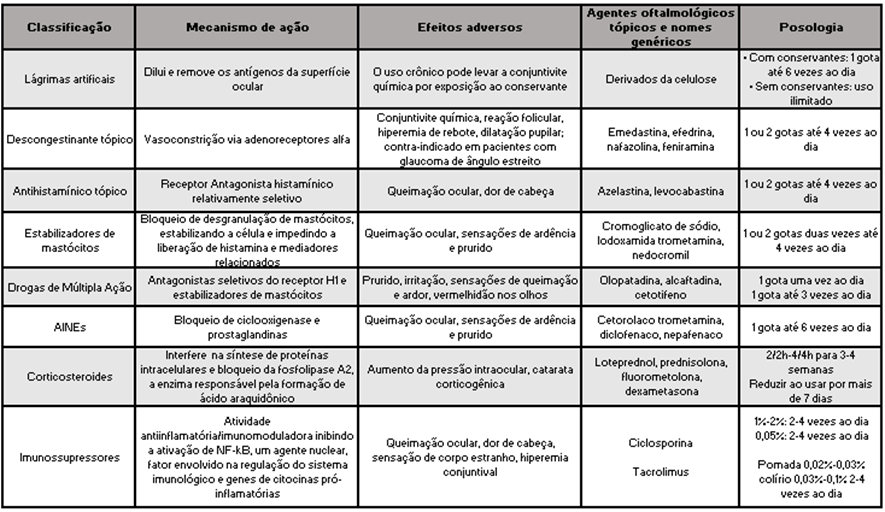
Tabela 3. Aplicabilidade das modalidades de tratamento para conjuntivite alérgica de acordo com sua gravidade (grau de recomendação D)
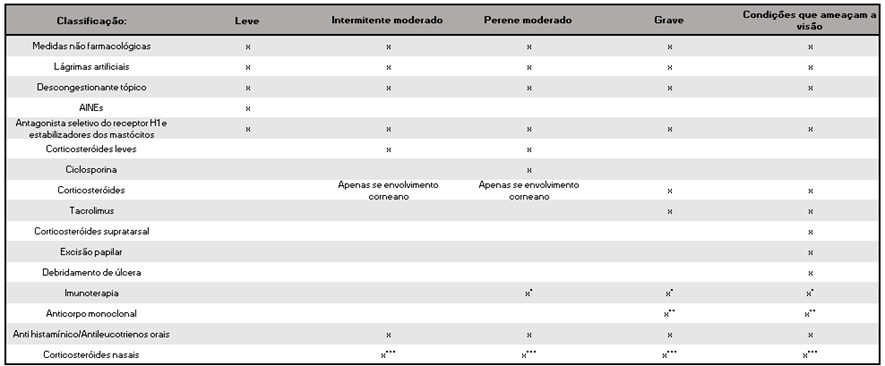
AINEs = anti-inflamatórios não esteroides
* Considere imunoterapia específica em casos persistentes ou quando associado a outras alergias.
** Considere terapia monoclonal de anticorpos.
*** Quando associado com sintomas nasal.
Grau de recomendação D: Opinião desprovida de avaliação crítica, baseada em consensos, estudos fisiológicos ou modelos animais. – Associação Médica Brasileira (AMB).
Os pacientes devem ser orientados a não esfregar os olhos, pois a fricção pode causar degranulação mecânica dos mastócitos e piora dos sintomas. A longo prazo o hábito de coçar os olhos é um fator de risco para o desenvolvimento do ceratocone, uma importante causa de transplante de córnea no Brasil18.
A aplicação de colírios de lágrimas artificiais ou soluções oculares sem conservantes são úteis para diluir e remover antígenos da superfície ocular, reduzindo a concentração de mediadores no filme lacrimal, e consequentemente os sintomas alérgicos. Por outro lado, a lavagem frequente dos olhos com água corrente deve ser evitada, uma vez que pode reduzir a estabilidade da camada lacrimal19.
Embora a aplicação de lágrimas artificiais não tenha efeito profilático sobre a resposta alérgica ocular, a utilização pode atenuar sinais oculares de inflamação, como hiperemia conjuntival e aumento da temperatura da superfície ocular, em especial durante um episódio agudo de conjuntivite alérgica. O uso de colirios de lágrimas artificiais gelados podem atenuar a sensação de coceiras nos pacientes com conjuntivite alérgicas.
Estudo envolvendo a exposição controlada ao pólen de gramíneas em pacientes com conjuntivite alérgica sazonal mostrou que a combinação da aplicação de lágrimas artificiais e compressas frias, em conjunto com colírio de anti-histamínico, foi superior ao uso isolado da medicação para a redução do tempo e intensidade dos sintomas20.
De um modo geral, os pacientes devem reduzir ou interromper o uso de lentes de contato durante os períodos sintomáticos, devido à propensão dos alérgenos de aderir às superfícies das lentes de contato. Os agentes de limpeza de lentes, juntamente com as soluções de armazenamento e enxágue devem ser isentos de conservantes, uma vez que as reações de hipersensibilidade a estas substâncias podem contribuir para a reação inflamatória. Soluções salinas caseiras não são recomendadas, devido ao risco de contaminação.
As conjuntivites alérgicas leves são as mais frequentes e em sua maioria IgE mediadas e portanto seu tratamento depende do diagnóstico etiológico que pode ser realizado através de testes cutâneos com leitura imediata, pesquisa de IgE específica sérica ou provocação conjuntival com alérgenos21. Nos casos crônicos, de difícil manejo, a abordagem multidisciplinar pode acrescentar novas e valiosas modalidades terapêuticas no controle da inflamação12.
Assim, a abordagem conjunta envolvendo principalmente os médicos oftalmologistas e alergologistas, aliada a identificação e tratamento das comorbidades, constitui um pilar fundamental no tratamento integrado das doenças alérgicas da superfície ocular. Esta colaboração estratégica visa não apenas minimizar os sintomas, mas também promover uma abordagem abrangente, proporcionando uma otimização do pré operatório e dos resultados cirúrgicos.
Tratamento de Primeira Linha:
O tratamento inicial para a alergia ocular prioriza medidas preventivas, visando afastar o indivíduo de agentes desencadeantes específicos e inespecíficos da alergia. Compressas geladas e lágrimas artificiais são indicadas para alívio sintomático, especialmente em casos leves. O acompanhamento com um médico alergista é imperativo em todas as formas de alergia ocular.
Tratamento de Segunda Linha:
No contexto do tratamento oftalmológico, as Drogas de Múltipla Ação (DMA) emergem como uma classe proeminente de antialérgicos tópicos, caracterizadas pela sinergia de anti-histamínicos, estabilizadores de membranas de mastócitos e propriedades anti-inflamatórias. Este grupo farmacológico possui grande importância no tratamento atual das alergias oculares, evidenciando uma eficácia singular.
A vantagem da DMA reside na celeridade proporcionada no alívio sintomático durante a fase aguda, resultante do bloqueio dos receptores de histamina. Adicionalmente, a capacidade estabilizadora de membrana de mastócitos dessas drogas não apenas atenua os sintomas agudos, mas também desempenha um papel crucial na prevenção da recorrência e cronificação das manifestações alérgicas. Destaca-se, ainda, sua ação indireta sobre os eosinófilos, células efetoras fundamentais na fase tardia da resposta alérgica.
Essas DMA constituem uma escolha terapêutica versátil, indicada tanto para formas agudas quanto crônicas de alergia ocular. Dentre as DMA amplamente empregadas, incluem-se o Colírio de Olopatadina nas concentrações de 0,1% ou 0,2%, Alcaftadina 0,25%, Epinastina 0,05% e Cetotifeno 0,25%.
A seleção criteriosa e a adaptação à individualidade do paciente no pré operatório e manejo pós cirúrgico são fundamentais, e considerando fatores como gravidade dos sintomas e tolerabilidade, auxiliam na otimização dos resultados terapêuticos.
Este arsenal farmacológico, ao proporcionar alívio imediato e prevenção da evolução desfavorável das alergias oculares e da inflamação ocular, destaca-se como um pilar essencial na abordagem clínica dessas condições oftalmológicas complexas.
Tratamento de Terceira Linha:
Corticosteroides Tópicos:
Em situações de alergia ocular com agudização da inflamação e principalmente com acometimento corneano, a utilização breve de corticosteroide tópico pode ser útil especialmente em manifestações como ceratite, úlcera em escudo e nódulos de Horner-Trantas.
Contudo, o uso de corticosteroides tópicos não estão isentos de considerações cautelares devido aos efeitos colaterais associados, incluindo hipertensão ocular, glaucoma, catarata corticogênicas, retardo na cicatrização do período de pós operatorio e predisposição a infecções. A ponderação cuidadosa desses riscos é essencial na tomada de decisão terapêutica.
Imunomoduladores:
A imunomodulação tópica emerge como uma alternativa promissora no tratamento a longo prazo das ceratoconjuntivites alérgicas. Tacrolimus a 0,03% em forma de colírio ou pomada tem demonstrado eficácia na supressão da inflamação alérgica, reduzindo a dependência de corticosteroides tópicos e proporcionando controle sustentado da doença. No caso de colírio a preferência é que o tacrolimus seja diluido em solução aquosa e sem conservante. Concentrações mais altas de tacrolimus 0,1% podem ser propostas nos casos de difícil controle. Ciclosporina A colírio com concentrações que variam de 0,05 a 2% constitui outra opção vigência de indicação de imunomodulação tópica.
Injeção Supratarsal de Corticosteroides:
Para casos mais desafiadores, caracterizados por papilas gigantes em conjuntiva tarsal superior, envolvimento límbico severo ou úlceras corneanas recorrentes, a injeção supratarsal de corticosteroides surge como uma opção terapêutica.
Resultados satisfatórios, embora transitórios, podem ser alcançados com injeções supratarsais de triamcinolona ou dexametasona, efetivamente suprimindo a inflamação nas ceratoconjuntivites alérgicas. Esta abordagem reserva-se para situações em que as modalidades convencionais revelam-se insuficientes.
Tratamento de Quarta Linha:
Tratamento Cirúrgico:
Em situações desafiadoras estratégias cirúrgicas prévias ao transplante de córnea e a cirurgia de pterígio são necessários pois na presença de ceratite grave e/ou úlceras de repetição resistentes ao tratamento convencional, a exérese das papilas gigantes associada ou não a enxertos, como de conjuntiva, mucosa oral ou membrana amniótica, além da criodestruição das papilas gigantes pode ser indicado.
Tratamento Sistêmico:
Em situações extremas de ceratoconjuntivites alérgicas resistentes às terapias convencionais e em concomitância com quadros atópicos de difícil controle, a abordagem sistêmica torna-se essencial. Nesse contexto, a colaboração interdisciplinar com alergologistas é imperativa. Ciclos breves de corticosteroides sistêmicos, sob monitoramento rigoroso dos efeitos colaterais, podem ser considerados. A imunossupressão sistêmica, especialmente com o uso de ciclosporina A e tacrolimus (FK506), tem se mostrado eficaz em casos extremos com múltiplas alergias de difícil controle. Monitorização clínica e laboratorial mensal é crucial, dada a possibilidade de efeitos colaterais, como nefrotoxicidade.
Tratamentos Adjuvantes:
A modulação do sistema imunológico pode ser alcançada através da imunoterapia alérgeno-específica ou com o uso de medicações. Embora a imunoterapia tenha evidenciado eficácia e segurança como adjuvante no tratamento das conjuntivites alérgicas, seu papel em casos mais severos de ceratoconjuntivites alérgicas ainda carece de evidências substanciais.
Perspectivas Futuras:
Anticorpos Monoclonais:
Os anticorpos monoclonais representam uma promissora linha de frente para o controle das doenças alérgicas, e poderão ser uma alternativa também para o controle das alergias oculares. O Omalizumabe (Xolair Genentech®), um anticorpo monoclonal anti-IgE indicado para asma e urticária crônica, tem demonstrado também atuação no controle das ceratoconjuntivites alérgicas graves22. Outra perspectiva é o uso do Dupilumabe (Dupixent Sanofi®)23, um anticorpo monoclonal anti-IL 4 indicado para dermatite atópica, que sugere potencial aplicação futura no tratamento de ceratoconjuntivites alérgicas de difícil controle.
TRANSPLANTES DE CÓRNEA
No Brasil, as ceratites infecciosas, traumas, ceratocone, distrofia endotelial de Fuchs e a ceratopatia bolhosa pós-cirurgia de catarata ainda despontam como as principais indicações de transplante de córnea24.
O ceratocone é uma doença de origem hereditária, degenerativa e principalmente relacionada ao hábito de coçar os olhos, em muito casos está associado a alergias oculares. Atinge uma em cada 2 mil pessoas, aflige crianças, adolescentes e adultos jovens e caracterizando-se por uma redução progressiva na espessura da parte central da córnea, que é empurrada para fora, formando uma saliência com o formato de um cone, daí a origem de seu nome18.
O ceratocone leva ao aparecimento de miopia e elevado grau de astigmatismo irregular, com acentuada baixa da acuidade visual. Os sintomas apresentados pelo paciente, no início da doença, são desconforto visual, dor de cabeça, fotofobia, diminuição da visão e troca frequente das lentes dos óculos. O Ceratocone ainda é a principal causa de transplantes de córnea: entre os mais de 23 mil transplantes realizados por ano no Brasil, mais de 13 mil são de córnea25,26. |
No contexto de transplantes de córnea e exérese de pterígio, a alergia ocular pode apresentar-se como uma complicação adicional, induzindo a neovascularização e impactando a integridade do enxerto, processo de cicatrização e a evolução pós-cirúrgica.
O transplante de córnea é singular, pelo fato de ser habitualmente realizado em pessoas com deficiência visual, mas com expectativa de vida, mobilidade e convivência social preservadas. As doenças corneanas são a segunda causa de cegueira reversível no mundo. O transplante de córnea é o procedimento de maior sucesso entre os transplantes e tem sido o mais realizado na atualidade27. Os Estados Unidos da América (EUA) é o país com maior número absoluto de transplantes de córneas, porém o Brasil possui hoje o maior programa público de transplantes de órgãos e tecidos do mundo28.
O transplante de córnea refere-se à substituição do tecido corneano alterado do paciente por uma córnea doadora saudável. O implante do enxerto de córnea (Ceratoplastia) pode ser didaticamente dividido nas seguintes técnicas (Figura 4):
• Transplante Penetrante: substituição da espessura total da córnea.
• Transplante Lamelar Anterior: substituição das camadas externas da córnea.
• Transplante Lamelar Posterior ou Transplante Endotelial: substituição das camadas internas da córnea: técnicas de DSAEK (Descemet Stripping Automated Endothelial Keratoplasty) e DMEK (Descemet Membrane Endothelial Keratoplasty).
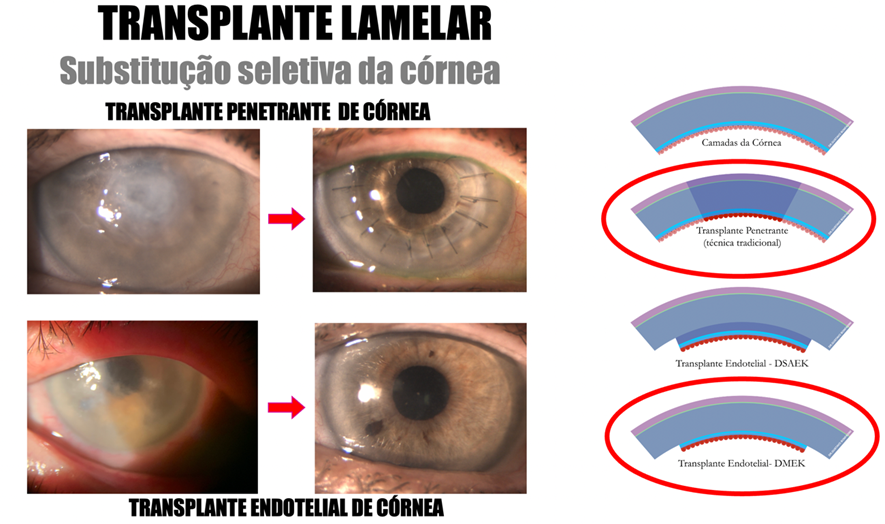
PREVENÇÃO DA REJEIÇÃO DO TRANSPLANTE DE CÓRNEA
A prevenção da rejeição no transplante de córnea requer abordagem abrangente nos estágios pré-operatório, intra-operatório e pós-operatório.
Na fase pré-operatória, o objetivo é reduzir possíveis inflamações, alterações de superfície ocular como alergias, olho seco, blefarite e meibonite. Durante o procedimento, a prevenção é realizada através da utilização de técnicas cirúrgicas dos transplantes lamelares com substituição seletiva e isolada de camadas da córnea doente, permitindo que a quantidade de antígenos seja diminuída substancialmente.
No pós-operatório, o controle das causas pró inflamatórias e da resposta imune do receptor é essencial para evitar rejeições.
A principal razão para os bons resultados do transplante de córnea é o privilégio imunológico da córnea. Este privilégio deve-se a desvio imunológico que ocorre no segmento anterior do olho, conhecido pela sigla ACAID (Anterior Chamber Associated Immune Deviation)29-32. Os fatores que contribuem para a formação do ACAID são:
– Ausência de vasos sanguíneos na córnea Ausência de vasos linfáticos na córnea;
– Barreira hemato-aquosa;
– Pequena quantidade de células apresentadoras de antígenos (CAAgs) no centro da córnea;
– Indução de apoptose pelo sistema Fas—Fas-ligand (CD-95L) na câmara anterior do olho;
– Fatores imunomoduladores: Transforming growth factor – ß (TGF- ß), peptídeo vaso inibitório (VIP), melanocyte-stimulating hormone (MSH);
Baixa expressão de antígenos MHC (major histocompatibility complex) de classe II
O controle da resposta imune do receptor no período pós-operatório é, atualmente, a melhor estratégia para a prevenção da rejeição de transplante de córnea. Esse controle pode ser conseguido através da diminuição da vascularização corneana e da terapia imunossupressora. A vascularização corneana facilita o transporte celular nos braços aferente e eferente do processo de rejeição. Diversos tratamentos podem suprimir ou diminuir a vascularização: controle da inflamação e alergia ocular, cauterização, aplicação de laser de argônio, irradiação, corticóides, transplante de células tronco e mais recentemente o uso de antiangiogênicos, como o bevacizumab33.
O sucesso do transplante de córnea está intrinsecamente ligado a técnica cirúrgica realizada e ao acompanhamento frequente dos pacientes. Controle de possíveis inflamações, administração adequada de corticosteroides e outros imunossupressores, a correta remoção de suturas e a fácil acessibilidade do paciente ao médico oftalmologista e ao centro transplantador são fatores críticos para garantir resultados positivos no transplante.
PTERÍGIO
O pterígio é um problema comum que se apresenta em todas as práticas oftalmológicas no mundo, sendo mais prevalente em ambientes equatoriais e os fatores de risco incluem exposição ao sol por mais de 5 horas, morar em áreas rurais, ocupações ao ar livre e idade mais avançada, enquanto o uso de óculos de sol e não fumar são fatores protetores34. A areia e poeira em suspensão também podem agravar a incidência e prevalência do pterígio em uma população.
A patologia de um pterígio demonstra degeneração elástica e proliferação fibrovascular.
A palavra pterígio vem do grego pteron (asa), como referência ao formato do tecido fibrovascular neoformado que delamina centrípeta e superficialmente a córnea e traciona a conjuntiva bulbar. Essa neoformação triangular ou trapezoidal habitualmente se dispõe ao longo do eixo horizontal da fenda interpalpebral e, com maior frequência, no limbo medial35.
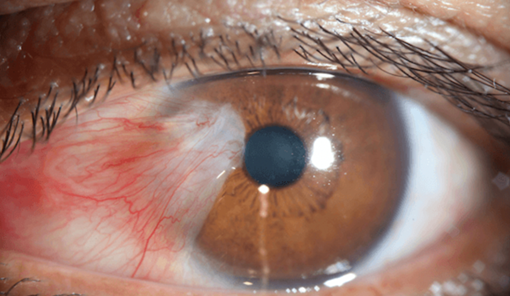
O pterígio pode resultar em perda visual significativa, inicialmente secundária ao astigmatismo induzido, e se negligenciado, o pterígio pode invadir o eixo visual.
Muitos pacientes buscam tratamento para reduzir os sintomas frequentemente associados à sensação de corpo estranho, lacrimejamento reflexo, coceira e inflamação. Episódios intermitentes de vermelhidão muitas vezes levam os pacientes a buscar tratamento por razões estéticas. Os olhos são críticos no convívio social e definição de beleza de todas as culturas, e risco de comprometimento visual junto a uma má estética é uma indicação importante para a cirurgia de pterígio.
PREVENÇÃO DA RECIDIVA DO PTERÍGIO APÓS A CIRURGIA
A arte da cirurgia de pterígio começa na avaliação e controle da inflamação ocular e identificação dos potenciais fatores de risco associados a recidiva como:
– Alergia ocular36.
– Pacientes jovens.
– Características que indiquem crescimento ativo do pterígio (episódios repetidos de inflamação, vascularização, ausência da linha de Stocker e presença de dellen na córnea à frente da cabeça do pterígio).
– Doença do olho seco e Síndrome de Sjögren. (existe uma considerável sobreposição entre olho seco e alergias)
– Blefarite e doenças das glândulas de Meibomius.
– Demodicose ocular (infecção por ácaros: Demodex folliculorum e Demodex brevis)37,38.
O tratamento do pterígio primário pequeno (tipo I) é feito de forma preferencialmente clínica, com compressas frias, instilação de lágrimas artificiais e de colírios vasoconstritores para a redução temporária da hiperemia conjuntival. Quando a cirurgia é indicada, a técnica cirúrgica sugerida é a excisão do pterígio e a área de esclera exposta deve ser recoberta com deslizamento de retalho conjuntival.
Uma técnica cirúrgica adequada é a base para o sucesso; no entanto, o manejo da alergia, olho seco, disfunção das glândulas de Meibomio e blefarite não deve ser ignorado.
A cápsula de Tenon é uma fáscia fina que reveste o globo ocular, e se insere na esclera anteriormente. A superfície interna da fáscia é lisa e separada da esclera por um espaço virtual chamado de espaço episcleral.
A programação cirúrgica na exérese de pterígio deve ser exercida quanto à quantidade de conjuntiva a ser removida, quão extensa deve ser a dissecação da tenon patológica, se deve ou não aplicar antimetabólitos como a Mitomicina C a 0.02% aplicada durante 1-3 minutos sobre a área de esclera exposta e, especialmente, como o defeito deixado pela excisão cirúrgica será gerenciada.
É sabido que os pterígios estão associados à inflamação, assim como a doença da superfície ocular, alergia ocular e olho seco. Juntas, essas entidades podem perpetuar uma à outra, sendo necessário controlar a alergia ocular o olho seco e a inflamação da superfície ocular para obter resultados cirúrgicos bem-sucedidos e prevenir a recorrência em pacientes com pterígio39. Genes associados à reparação do DNA, proliferação celular, migração e angiogênese têm sido demonstrados como associados aos pterígios40.
Às vezes, pacientes negligenciados desejam ter o olho sem vermelhidão e o pós operatório de exérese de pterígio com maior conforto e no menor período possível após a cirurgia, por isso se faz necessário um controle adequado dos fatores pró inflamatórios como a alergia ocular e considerar o uso das terapias anti-inflamatórias antes e depois da cirurgia associados a uma adequada técnica cirúrgica como transplante autólogo de conjuntiva.
Um resultado anatômico excelente é, claro, crucial, mas muitos pacientes julgarão o resultado cirúrgico e o cirurgião com base no resultado estético, funcional com uma taxa mínima de recorrência.
Além disso, a cirurgia de pterígio deve ser preferencialmente realizada antes de cirurgias refrativas corneanas e de catarata.
CONJUNTIVITE ALÉRGICA E HIPERSENSIBILIDADE A FÁRMACOS:
As reações de hipersensibilidade os fármacos oftálmicos podem se manifestar com sintomas oculares inespecíficos, como fotofobia, edema palpebral, hiperemia conjuntival, quemose, prurido ou sensação de corpo estranho. São mais comumente decorrentes dos preservantes dos colírios (cloreto de benzalcônio), de substâncias de soluções de conservação de lentes de contato (timerosal) ou da ação direta do agente químico. O diagnóstico é geralmente feito por exclusão de outras doenças41.
O tratamento das reacões tóxicas papilares e foliculares fundamenta-se na retirada da medicação e na prescrição de lágrimas artificiais sem conservantes. Em geral não há benefício com corticoides tópicos, uma vez que eles também têm conservantes. Preparações em gel podem ser úteis no tratamento das ceratites puncttatas. Defeitos epiteliais persistentes podem ser tratados com lentes de contato terapêuticas41.
REAÇÕES DE HIPERSENSIBILIDADE PERIOPERATÓRIAS:
A anafilaxia perioperatória representa uma manifestação rara no cenário de eventos adversos associados à cirurgia de transplante de córnea e exerese pterígio. É mais comum em adultos e existe associação com idade, presença de doenças cardiovasculares e reações prévias a medicamentos. É mais frequente que as manifestações iniciem antes ou durante a fase de indução anestésica42. Os desencadeantes principais de anafilaxia operatória identificados em diversos levantamentos são: bloqueadores neuromusculares, antibióticos, látex, opiáceos, analgésicos como hyalozima, anti-inflamatórios não-esteroidais, clorexidina, contrastes, corantes, óxido de etileno. Existe variação entre os agentes precipitantes observados em locais diferentes43.
POSSÍVEIS AGENTES CAUSAIS:
Bloqueadores neuromusculares: São a causa mais comum de reações de hipersensibilidade perioperatória na Europa44. É necessário ressaltar que, mesmo quando um agente bloqueadores neuromuscular causador é claramente identificado e outras opções têm testes cutâneos negativos, estes são considerados opções habitualmente seguras, porém não é possível descartar totalmente uma nova reação45.
Látex: A diminuição das reações ao látex de borracha natural da Hevea brasiliensisvem vem sendo observada como resultado de várias ações, como identificação dos grupos de risco e uso de medidas preventivas, rotulação correta dos dispositivos médicos quanto a presença de látex46, e uso de luvas sem pó47.
Clorexidina: É um antisséptico utilizado de forma ampla no ambiente cirúrgico oftalmológico, desde o uso cutâneo, até como componente de gel de anestésicos locais, soluções oftálmicas ou cateteres previamente impregnados com a substância. Está presente no ambiente extra-hospitalar em enxaguantes bucais, dentifrícios, demaquilantes, curativos e soluções antissépticas de uso doméstico46. O paciente pode ter feito uso desses produtos previamente, sem apresentar qualquer reação. A exposição é aumentada pela absorção através da superfície mucosa ou pele incisada. Os testes cutâneos têm se mostrado preditivos da sensibilidade alérgica e correlacionados com a dosagem da IgE específica.
A clorexidina pode estar oculta em diversos produtos de uso perioperatório, e deve fazer parte da investigação dos casos de anafilaxia, inclusive naqueles em que não se dispõem de informes sobre os agentes utilizados48.
Povidona: Presente também em sabonetes, soluções antissépticas oftálmicas, são raros os casos, mas casos documentados com testes cutâneos associados à dosagem de triptase foram publicados49. Vale ressaltar que o antígeno principal identificado é a povidona, e não o iodo50, e não há reação cruzada com meios de contraste iodados51.Testes cutâneos são recomendados para o diagnóstico, e as diluições estão padronizadas52.
Anestésico local: A hialuronidase, HYALOZIMA® é uma enzima derivada de bovinos e ovinos e é altamente alergênica. É bastante utilizada na anestesia como forma geral e na oftalmologia é utilizada para otimizar e acelerar o efeito do anestésico utilizado e facilita a penetração nos tecidos. Degrada o ácido hialurônico e pode ser usada como adjuvante em anestésicos locais para facilitar a penetração nos tecidos. Reações imediatas à hialuronidase têm sido descritas53.
Até mesmo reações tardias, com edema e compressão da região periorbitária, podem ter consequências desastrosas nas cirurgias oftalmológica54,55. Conhecer que ela pode mimetizar uma celulite orbitária é de extrema importância para o cirurgião oftalmológico, pois o diagnóstico diferencial com celulite orbitária precoce deve ser feito nos casos de edema e hiperemia, sob risco de que compressão compartimental e perda visual ocorram, por retardo na elucidação da causa eitiológica56.
Hipnóticos: As reações aos hipnóticos eram mais frequentes com o tiopental (cujo uso atualmente está em declínio) e com o propofol, quando este tinha em sua formulação o solubilizante Cremophor EL57.
O propofol tem dois grupos isopropila, que atuam como determinantes antigênicos, além de apresentar, em sua formulação atual, solução lipídica com óleo de soja e lecitina de ovo57.
A lecitina da formulação do propofol é derivada da gema de ovo e altamente purificada, e os pacientes alérgicos ao ovo tendem a mostrar sensibilização e reagir à proteína da clara58. O óleo de soja usado para a solução de propofol é refinado, sendo as proteínas alergênicas retiradas ao final do processo.
A Academia Americana de Alergia, Asma e Imunologia recentemente deliberou que pacientes alérgicos ao ovo podem receber, com segurança, anestesia sem qualquer precaução, sendo essa orientação repetida em revisão recente59. Etomidato, cetamina e os benzodiazepínicos raramente estão implicados; dentre os últimos, o midazolam é o agente mais frequente60.
Anti-inflamatórios não esteroidais (AINEs): são muito utilizados nas cirurgia de transplante de córnea e exerese de pterígio, seja no pré, intra ou pós-operatório. Apesar da pouca frequência das reações perioperatórias aos AINEs, nos casos de reação perioperatória prévia não investigada, sugere-se o uso de paracetamol e inibidores seletivos de COX-261, compostos sabidamente pouco envolvidos nas reações de hipersensibilidade a AINEs, tanto por mecanismos imunológicos, quanto por não imunológicos.
Antibióticos: são utilizados em todos os períodos perioperatório e pós-operatório, seja para profilaxia ou tratamento de infecções oculares. A rotulação indiscriminada de alergia aos betalactâmicos, notadamente à penicilina, é uma questão que merece ser comentada. Alergia à penicilina é relatada em aproximadamente 10% da população. Porém, em pelo menos 90% deles, esse rótulo poderia ser retirado, por história detalhada ou por avaliação com um alergologista62. Existem também relatos de reações perioperatórias à vancomicina e às quinolonas, porém a confirmação de seu papel como agente etiológico – mediante testes cutâneos para pesquisa de IgE específica – é bastante prejudicada, uma vez que tais compostos, degranuladores diretos dos mastócitos, podem liberar histamina, independentemente da produção de IgE específica63.
O perioperatorio é um momento de bastante atenção para casos de reações alérgicas e anaflactoides. Muitos medicamentos são ministrados num curto espaço de tempo e sabemos que dependendo da via administrada o início da reação pode ser imediata (minutos) ou tardia (horas). Devemos lembrar que existem diversos tipos de reações de hipersensibilidade e uma história clínica colhida previamente é de suma importância para a adoção medidas que as evitem. Porém muitas vezes são inevitáveis.
Uma avaliação abrangente, a identificação precisa de medicamentos, antissépticos e outras substâncias utilizadas na região periocular, juntamente com registros detalhados de antecedentes clinicos do paciente e uma nomenclatura padronizada, são elementos cruciais para obter dados epidemiológicos mais confiáveis sobre a anafilaxia perioperatória.
CONCLUSÃO
– Conjuntivite alérgica: Resposta imune do tipo IgE mediada, cursa com prurido ocular ou periocular, lacrimejamento e hiperemia conjuntival, que podem ser persistentes ou sazonais.
– A alergia ocular é comum, porém subdiagnosticada, podendo levar a danos significativos à saúde ocular, como cicatrizes corneanas, afetando a visão e a cirurgia ocular. Frequentemente associada a outras manifestações alérgicas, como rinite, asma e dermatite atópica.
– Diagnóstico: Baseia-se na história de atopia, sintomas oculares e, quando necessário, exames adicionais.
-Tratamento: Objetiva eliminar alérgenos, modular resposta imune e controlar mediadores químicos da inflamação. Inclui tratamento tópico antialérgico e, em casos refratários, abordagens terapêuticas mais agressivas.
1) Primeira Linha: Medidas preventivas e alívio sintomático com compressas frias e lágrimas artificiais.
2) Segunda Linha: Uso de Drogas de Múltipla Ação (DMA), incluindo colírios de Olopatadina, Alcaftadina, Epinastina e Cetotifeno.
3) Terceira Linha: Corticosteroides tópicos e imunomoduladores para controle de inflamação aguda e crônica.
4) Quarta Linha: Abordagens cirúrgicas e sistêmicas para casos refratários.
– Transplantes de Córnea: Sucesso ligado à técnica cirúrgica e controle pós-operatório da inflamação causada pela alergia ocular.
– Exerese de Pterígio: Prevenção de recidiva pós-cirúrgica envolve controle da alergia, inflamação ocular e identificação de fatores de risco.
– Hipersensibilidade a Fármacos: Reações podem ser desencadeadas por conservantes de colírios e outras substâncias, com tratamento baseado na retirada do agente causador e uso de lágrimas artificiais.
– Reações Perioperatórias: Anafilaxia perioperatória é rara, mas significativa, e o controle dos fatores de risco é essencial.
REFERÊNCIAS:
1. Geraldini M, Neto HJC, Riedi CA, Rosário NA. Epidemiology of ocular allergy and comorbidities in adolescents. J Pediatr (Rio J.). 2013;89:354-60. doi: 10.1016/j.jped.2013.01.001.
2. CBO – Série Oftalmologia Brasileira – Anatomia Aparelho Visual 4. Edição, ISBN: 8570065795, ISBN13: 9788570065797
3. Meng X-T, Shi Y-Y, Zhang H, Zhou H-Y. The Role of Th17 Cells and IL-17 in Th2 Immune Responses of Allergic Conjunctivitis. Journal of Ophthalmology. 2020;2020:1-9. doi: 10.1155/2020/6917185.
4. Ayad A. Farjo,Matthew V. Brumm,H. Kaz Soong,Christopher T. Hood. Capítulo 4.1; Corneal Anatomy, Physiology, and Wound Healing. Livro Ophthalmology. Elsevier, 2019.
5. Bielory L, Delgado L, Katelaris CH, Leonardi A, Rosario N, Vichyanoud P. ICON: diagnosis and management of allergic conjunctivitis. Ann Allergy Asthma Immunol. 2020;124(2):118-34.
6. Palmares J, Delgado L, Cidade M, Quadrado MJ, Filipe HP; Season Study Group. Allergic conjunctivitis: a national cross-sectional study of clinical characteristics and quality of life. Eur J Ophthalmol. 2010;20(2):257-64.).
7. Dinowitz M, Rescigno R, Bielory L. Ocular Allergic Diseases: Differential Diagnosis, Examination Techniques and Testing. In: Kemp SF, Lockey RF, eds. Diagnostic Testing of Allergic Disease, vol. 1. 1a ed. Basel: Marcel Dekker eds.; 2000. p. 127-50.
8. Nippon Ganka Gakkai Zasshi. 2010;114(10):831-70. Japanese Ocular Allergology S. Guidelines for the clinical management of allergic conjunctival disease (2nd edition). 2010;114(10):831-70. Japanese.
9. Mantelli F, Santos MS, Petitti T, Sgrulletta R, Cortes M, Lambiase A, Bonini S. Systematic review and meta-analysis of randomised clinical trials on topical treatments for vernal keratoconjunctivitis. Br J Ophthalmol. 2007 Dec;91(12):1656-61. doi: 10.1136/bjo.2007.122044.
10. Sánchez-Hernández MC, Navarro AM, Colás C, del Cuvillo A, Sastre J, Mullol J, et al. Validation of the DECA criteria for allergic conjunctivitis severity and control. Clin Transl Allergy. 2020;10:43. doi: 10.1186/s13601-020-00349-4.231
11. Efron N, Morgan PB, Katsara SS. Validation of grading scales for contact lens complications. Ophthalmic Physiol Opt. 2001 Jan;21(1):17-29.
12. Bielory L. Ocular allergy. Mt Sinai J Med. 2011;78(5):740-58.
13. Bielory L, Meltzer EO, Nichols KK, Melton R, Thomas RK, Bartlett JD. An algorithm for the management of allergic conjunctivitis. Allergy Asthma Proc. 2013;34(5):408-20.
14. Sánchez-Hernández MC, Montero J, Rondon C, Benitez del Castillo JM, Velázquez E, Herreras JM, et al.; SEAIC 2010 Rhinoconjunctivi- tis Committee; Spanish Group Ocular Surface-GESOC. Consensus document on allergic conjunctivitis (DECA). J Investig Allergol Clin Immunol. 2015;25(2):94-106.
15. Bielory L. Ocular allergy guidelines: a practical treatment algorithm. Drugs. 2002;62(11):1611-34.
16. Owen CG, Shah A, Henshaw K, Smeeth L, Sheikh A. Topical treatments for seasonal allergic conjunctivitis: systematic review and meta-analysis of efficacy and effectiveness. Br J Gen Pract. 2004;54(503):451-6.
17. Roberts G, Pfaar O, Akdis CA, Ansotegui IJ, Durham SR, Gerth van Wijk R, et al. EAACI Guidelines on allergen immunotherapy: allergic rhinoconjunctivitis. Allergy. 2018;73(4):765-98.
18. Bonfadini G, Kim EC, Campos M, Jun AS. Novel spatula and dissector for safer deep anterior lamellar keratoplasty. Rev Bras Oftalmol. 2014;73(5):279-81. doi: 10.5935/0034-7280.20140060.
19. Miyazaki D, Takamura E, Uchio E, Ebihara N, Ohno S, Ohashi Y, et al. Japanese guidelines for allergic conjunctival diseases 2020. Allergology International. 2020;69:346-55. doi: 10.1016/j. alit.2020.03.005.
20. Bilkhu PS, Wolffsohn JS, Naroo SA, Robertson L, Kennedy R. Effectiveness of nonpharmacologic treatments for acute seasonal allergic conjunctivitis. Ophthalmology. 2014;121:72-8. doi: 10.1016/j.ophtha.2013.08.007.
21. Hodges MG, Keane-Myers AM. Classification of ocular allergy. Curr Opin Allergy Clin Immunol. 2007;7(5):424-8.
22. Doan S, Amat F, Gabison E, Saf S, Cochereau I, Just J. Omalizu- mab in severe refractory vernal keratoconjunctivitis in children: Case series and review of the literature. Ophthalmol Ther. 2017;6(1):195-206.
23. Shirley M. Dupilumab: First Global Approval. Drugs. 2017 Jul;77(10):1115-1121.
24. Sano FT, Dantas PE, Silvino WR, Sanchez JZ, Sano RY, Adams F, et al. [Trends in the indications for penetrating keratoplasty]. Arq Bras Oftalmol. 2008;71(3):400-4.
25. Associação Brasileira de Transplante de Órgãos – ABTO. [Internet]. Registro Brasileiro de Transplantes; janeiro/dezembro 2023. [acesso em 2023 dez. 10]. Disponível em: <http://www.abto.org.br>|
26. Netto MJC, Giustina ED, Ramos GZ, Peccini RFC, Sobrinho M, Souza LBd. Principais indicações de transplante penetrante de córnea em um serviço de referência no interior de São Paulo (Sorocaba – SP, Brasil). Arq Bras Oftalmol 2006;69:661-4.
27. Whitcher, JP et al. Corneal blindness: a global perspective. Bull World Health Organ. 2001;79(3):214-21)
28. Bonfadini, Gustavo et al. Doação e fila de transplante de córnea no Estado do Rio de Janeiro. Rev. bras.oftalmol., Rio de Janeiro, v. 73, n. 4, p. 237-242, Aug. 2014.
29. Ing JJ, Ing HH, Nelson LR, Hodge DO, Bourne WM. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology. 1998;105(10):1855-65.
30. Pleyer U, Dannowski H, Volk HD, Ritter T. Corneal allograft rejection: current understanding. Immunobiology and basic mechanisms. Ophthalmologica. 2001;215(4):254-62.
31. The collaborative corneal transplantation studies (CCTS). Effectiveness of histocompatibility matching in high-risk corneal transplantation. The Collaborative Corneal Transplantation Studies Research Group. Arch Ophthalmol. 1992;110(10):1392-403.
32. Sit M, Weisbrod DJ, Naor J, Slomovic AR. Corneal graft outcome study. Cornea. 2001;20(2):129-33.
33. Bahar I, Kaiserman I, McAllum P, Rootman D, Slomovic A. Subconjunctival bevacizumab injection for corneal neovascularization. Cornea. 2008;27(2):142-7.
34. Rezvan F, Khabazkhoob M, Hooshmand E, Yekta A, Saatchi M, Hashemi H. Prevalence and risk factors of pterygium: a systematic review and meta-analysis. Surv Ophthalmol. 2018 Sep-Oct;63(5):719-735. doi: 10.1016/j.survophthal.2018.03.001. Epub 2018 Mar 16. PMID: 29551597.
35. CBO – Série Oftalmologia Brasileira –DOENÇAS EXTERNAS OCULARES E CÓRNEA 4. Edição, ISBN: 8570065795, ISBN13: 9788570065797 pag 435
36. Eyni Y, Kerman T, Hazan I, Rosenberg E, Lev Ari O, Knyazer B, Tsumi E. Are Periocular and Systemic Allergy Conditions Risk Factors for Pterygium? Semin Ophthalmol. 2023 Nov;38(8):722-726. doi: 10.1080/08820538.2023.2223266. Epub 2023 Jun 11. PMID: 37303165.
37. Huang Y, He H, Sheha H, Tseng SC. Ocular demodicosis as a risk factor of pterygium recurrence. Ophthalmology. 2013 Jul;120(7):1341-7. doi: 10.1016/j.ophtha.2013.01.001. Epub 2013 May 9. PMID: 23664471.
38. Luo X, Li J, Chen C, Tseng S, Liang L. Ocular Demodicosis as a Potential Cause of Ocular Surface Inflammation. Cornea. 2017 Nov;36 Suppl 1(Suppl 1):S9-S14. doi: 10.1097/ICO.0000000000001361. PMID: 28902017; PMCID: PMC5676568.
39. Reidy J. Corneal dystrophies, ectatic disorders and degenerations: pterygium. In: Holland E, Mannis M, eds. Cornea: Fundamentals, Diagnosis and Management. New York, NY: Elsevier; 2017:870–871.
40. Tan D, Chong E. Management of pterygium. In: Holland E, 228 Mannis M, eds. Cornea: Surgery of the Cornea and Conjunctiva. New York, NY: Elsevier; 2017:1560–1570.
41. CBO – Série Oftalmologia Brasileira –DOENÇAS EXTERNAS OCULARES E CÓRNEA 4. Edição, ISBN: 8570065795, ISBN13: 9788570065797 pag 195-196.
42. Moneret-Vautrin DA, Mertes PM. Anaphylaxis to general anesthetics. Chem Immunol Allergy. 2010;95:180-9.
43. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project (NAP6). Br J Anaesth. 2018;121(1):159-71.
44. Garvey LH, Ebo DG, Mertes PM, Dewachter P, Garcez T, Kopac P, et al. An EAACI position paper on the investigation of perioperative immediate hypersensitivity reactions. Allergy. 2019;74(10):1872-84.
45. Fraser BA, Smart JA. Anaphylaxis to cisatracurium following negative skin testing. Anaesth Intensive Care. 2005;33:816-9.
46. Volcheck GW, Hepner DL. Identification and management of perioperative anaphylaxis. J Allergy Clin Immunol Pract. 2019;7:2134-42.
47. Blaabjerg MS, Andersen KE, Bindeslev-Jensen C, Mortz CG. Decrease in the rate of sensitization and clinical allergy to natural rubber latex. Contact Dematitis. 2015;73:21-8.
48. Garvey LH, Roed-Petersen J, Husum B. Anaphylactic reactions in anaesthetized patients – four cases of chlorhexidine allergy. Acta Anaesthesiol Scand. 2001;45:1290-4.
49. Palobart C, Cros J, Orsel I, Nathan N. Choc anaphylactique à la povidone iodée. Ann Fr Anesth Reanim. 2009;28:168-70.
50. Dewachter P, Mouton-Faivre C. Allergie aux medicaments et aliments iodés: la sequence allergénique n’est pas l’iode. Presse Med. 2015;44(11):1136-45.
51. Laguna JJ, Archilla J, Doña I, Corominas M, Gastaminza G, Mayorga C, et al. Practical guidelines for perioperative hypersensitivity reactions. J Investig Allergol Immunol. 2018;28(4):216-32.
52. Scolaro RJ, Crilly HM, Maycock EJ, McAleers PT, Nicholls KA, Rose MA, et al. The Australian and New Zealand anaesthetic allergy group perioperative anaphylaxis investigation guidelines. Anaesth Intensive Care. 2017;45(5):543-55.
53. Lee HK, Choi EJ, Lee PB, Nahm FS. Anaphylactic shock caused by the epidurally-administered hyaluronidase. Korean J Pain. 2011;24:221-5.
54. Raichura ND, Alam MS, Jaichandran VV, Mistry S, Mukherjee B. Hyaluronidade allergy mimicking orbital cellulitis. Orbit. 2018;37(2):149-53.
55. Alcubierre R, Sanchez-Dalmau BF, Mousavi K. Compressive optic neuropathy secondary to an allergic reaction to hyaluronidase. Arch Soc Esp Oftalmol. 2019 Sep;94(9):441-4.
56. Halliday L, Sia PI, Durkin S, Selva D. Atypical case of hyaluronidase allergy with orbital compartment syndrome and visual loss. Clin Exp Ophtalmology. 2018;46(5):563-4.
57. Asseroj LL, Mosbech H, kroigaard M, Garvey LH. No evidence for contraindications to the use of propofol in adults allergic to egg, soy and peanuts. Br J Anaesth. 2016;116(1):77-82.
58. Blunk JA, Schmelz M, Zeck S, Skov P, Likar R, Koppert W. Opioid-induced mast cell activation and vascular response: an in vivo microdialysis study in human skin. Anesth Analg. 2004;98:364-70.
59. Michavila Gomez AV, Belver Gonzalez MT, Alvarez NC, Giner Muñoz MT, Hernando Sastre V, Porto Arceo JA, et al. Perioperative anaphylactic reactions: Review and procedure protocol in paediatrics. Allergol Immunopathol (Madr). 2015;43(2):203-14.
60. Galvão VR, Giavina-Bianchi P, Castells M. Perioperative anaphylaxis. Curr Allergy Asthma Rep. 2014;14(8):452.
61. Mertes PM, Malinovsky JM, Jouffroy L; Working Group of the SFAR and SFA, Aberer W, Tereehorst I, et al. Reducing the risk of anaphylaxis during anesthesia: 2011 update guidelines for clinical practice. J Investig Allergol Clin Immunol. 2011;21(6):442-53.
62. Penicillin Allergy in Antibiotic Resistance Workgroup. Penicillin allergy testing should be performed routinely in patients with self-reported penicillin allergy. J Allergy Clin Immunol Pract.
63. Nel L, Eren E. Peri-operative anaphylaxis. Br J Pharmacol. 2011;71(5):647-58.
Visite a página no Instagram Dr.Gustavo Bonfadini: https://www.instagram.com/gustavobonfadini/
Visite a página no Facebook Dr.Gustavo Bonfadini: https://www.facebook.com/pages/category/Doctor/DrGustavo-Bonfadini-358660714622734/
COMPARTILHE o vídeo e ajude outras pessoas com estas informações!